On appelle « filles DES » les femmes qui ont été exposées au DES dans l’utérus de leur mère. Leur nombre est évalué à 80 000 en France. Elles sont âgées de 46 à 75 ans en 2023.
Elles ont été confrontées à des complications : cancers, infertilité, accidents de grossesse. Leurs risques de cancers du col et du vagin restent majorés, par rapport à la population générale : elles ont besoin d’un suivi gynécologique spécifique.
Ce dossier comporte également une section dédiée aux conséquences communes de l’exposition au Distilbène pour les filles et les garçons de mères DES.
Conséquences pour les « Filles DES »
ANOMALIES DE L’APPAREIL GÉNITAL
Elles sont présentes chez les deux tiers des « filles DES » environ. Elles peuvent attirer l’attention sur l’exposition au DES ou aider à la confirmer.
Adénose
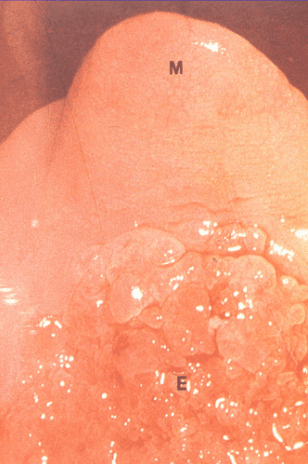
L’Adénose = présence d’épithélium glandulaire sur le col et/ou le vagin à la place d’un épithélium malpighien. (fig 1). L’adénose évolue spontanément vers une métaplasie c’est-à-dire un recouvrement puis remplacement par un épithélium malpighien.
Col
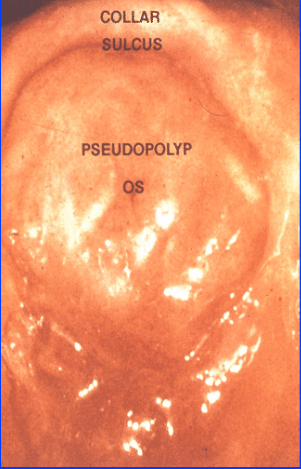
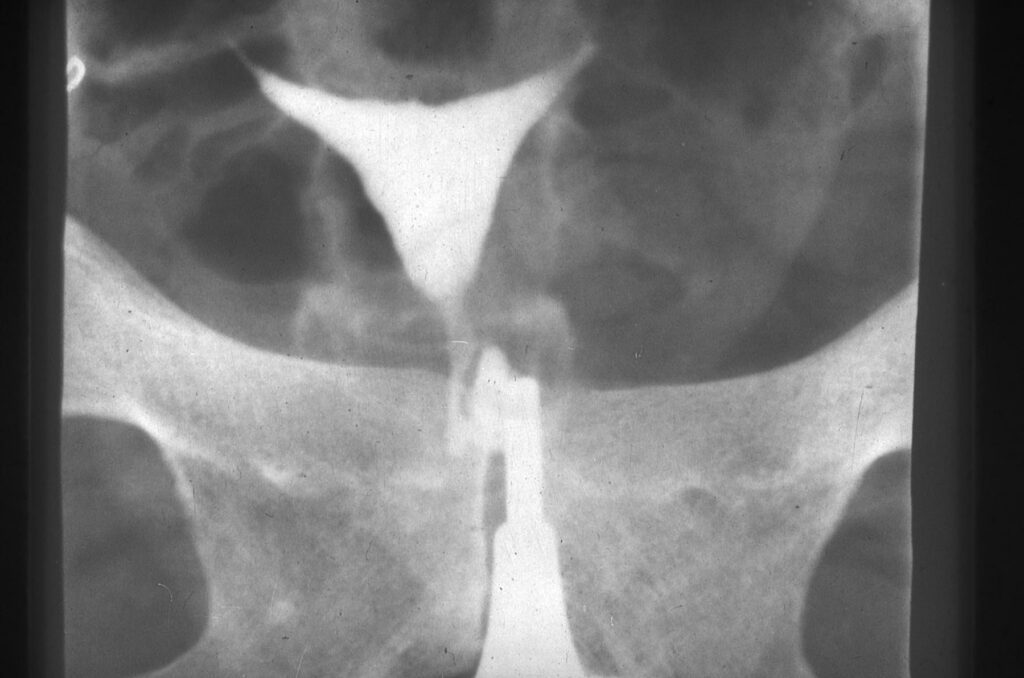
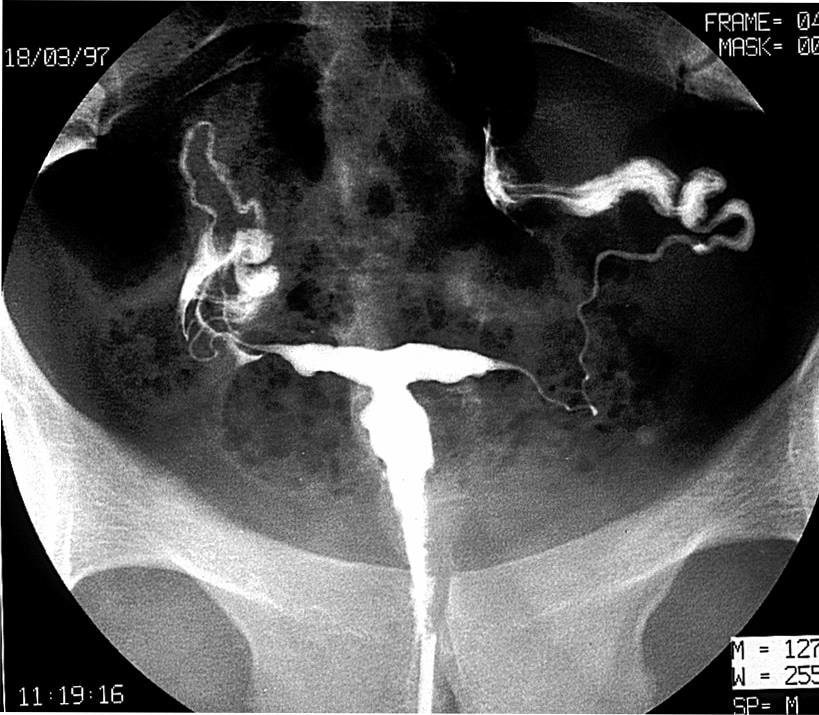
Aspects caractéristiques, saillie antérieure en “casquette d’aviateur“ (fig 1), col hypoplasique (fig 2), pseudo polype, sillon autour du col (fig 3).
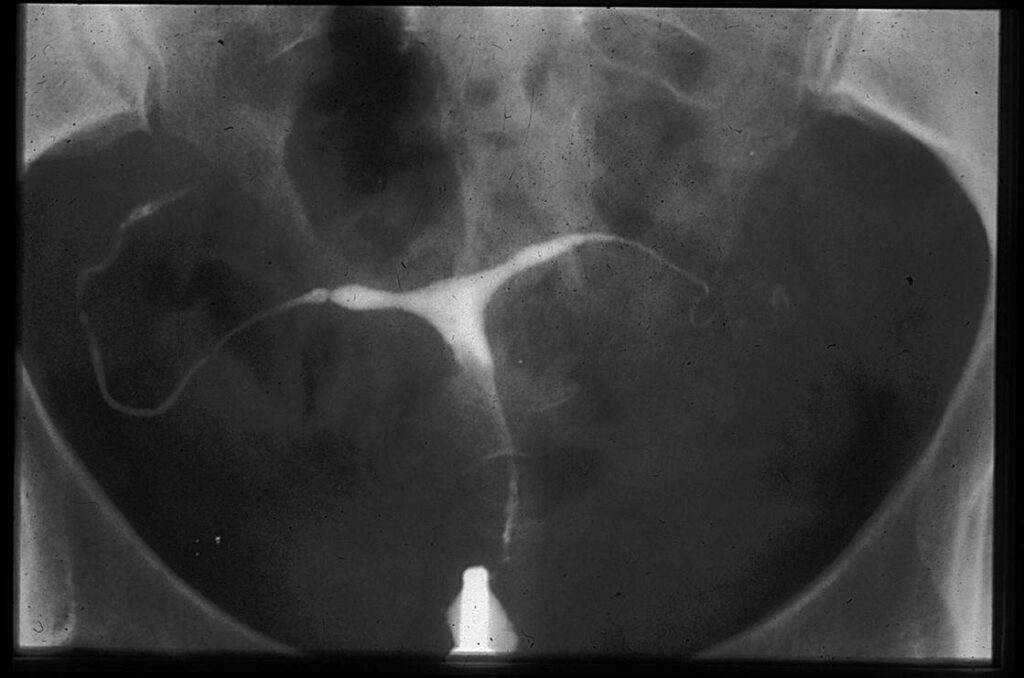
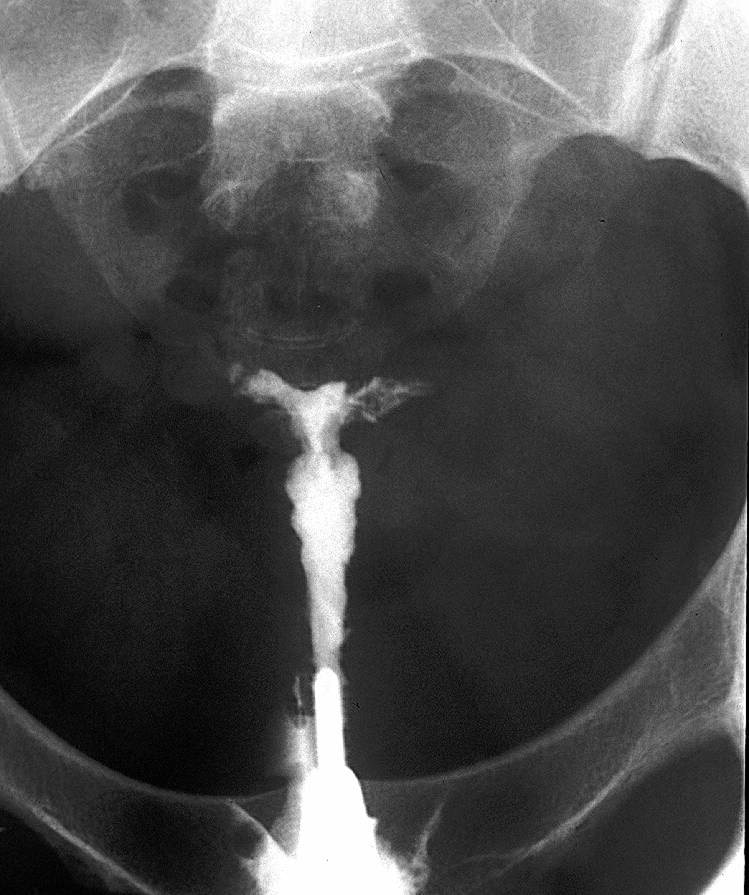
Utérus : utérus en « T », hypoplasique, avec rétrécissements.
En comparaison avec un utérus normal (fig 4), exemples de malformations typiques : utérus en T et hypoplasique (fig 5), utérus en T avec bords irréguliers et rétrécissements du corps (fig 6) et utérus en T avec rétrécissements au niveau du corps et des cornes (Fig 7).
CANCERS DU COL DE L’UTÉRUS ET DU VAGIN
Adénocarcinome à Cellules Claires (ACC) du col ou du vagin
La découverte du lien entre exposition in utero au DES et ACC date de 1971 (Herbst).
Fréquence
La dernière évaluation rapporte 1 cas pour 625 « filles DES » (Troisi 2007), soit plus d’une centaine de cas probables, au total, en France.
Causes
Des ACC peuvent se produire en dehors de l’exposition au DES. Cependant ches les « Filles DES », le risque est multiplié par 40 par rapport à celui de la population générale (Hoover 2011). L’ACC n’est pas dû au virus HPV. Son dépistage doit donc comporter l’examen cytologique.
Âges de survenue
Un pic de fréquence s’est produit chez les femmes jeunes, autour de 20 ans. Cependant, quelques cas plus tardifs ont été rapportés jusqu’à l’âge de 62 ans (Keller 2001, Verloop 2010, Smith 2012, Herbst 2015, Lee 2019). De plus, il a été observé, pour les ACC survenant chez des femmes non exposées au DES, un deuxième pic de fréquence autour de 71 ans, tranche d’âge que les « filles DES », âgées en France de 44 à 73 ans en 2021, commencent à atteindre (Hanselaar 1997).
Le niveau de risque d’ACC tardif a fait l’objet d’une étude menée en coopération avec l’Institut Gustave Roussy et des représentants de la Société Française de Colposcopie et Pathologie Cervico-Vaginale. Il n’y a que très peu de cas après 50 ans et parmi ceux-ci, aucune femme n’avait été exposée in utero au DES (Tournaire 2023).
C’est pour cette raison que les recommandations professionnelles, revues en 2024, incitent à dépister par l’examen cytologique (associé au test HPV) et à arrêter le dépistage après 65 ans.
Diagnostic
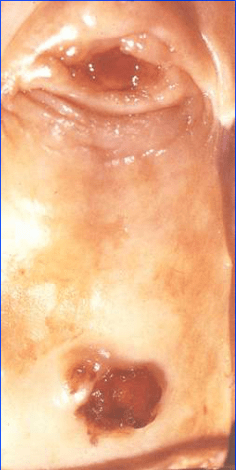
L’attention est parfois attirée par des saignements. La lésion est diagnostiquée :
- par l’examen au spéculum : lésion polypoïde (fig 2)
- lors du toucher vaginal : nodule du col ou du vagin qui peut être sous muqueux,
- • ou grâce au dépistage.
Une biopsie peut être faite directement ou orientée par la colposcopie.
Dysplasies cervicales ou vaginales
Rappel : dysplasie du col = lésion intra épithéliale cervicale = CIN = Cervical intraepithelial neoplasia.
Ces lésions dues aux virus HPV (Human papilloma virus) à haut risque peuvent évoluer, en l’absence de traitement, après plusieurs années, vers un cancer invasif.
Les lésions de haut grade du col de l’utérus ou du vagin, sont plus fréquentes chez les « filles DES » que chez les femmes non exposées : risque relatif multiplié par deux environ (Hatch 2001, Hoover 2011 et Troisi 2016).
Ces dysplasies ont une particularité chez les « filles DES » : elles peuvent se situer au niveau du vagin en plus de la localisation habituelle sur le col, d’où les recommandations de dépistage : prélèvement vaginal en plus du prélèvement cervical, à poursuivre après hystérectomie.
Dépistage des cancers et dysplasies du col et du vagin
Les modalités de dépistage en France sont précisées dans “Le dépistage du cancer du col de l’utérus en pratique” ( INCa 2020).
Deux tests sont possibles à partir d’un même prélèvement en utilisant le milieu de transport liquide :
- l’examen cytologique, analyse des cellules,
- le test HPV qui détecte les génotypes d’HPV à haut risque.
Deux modes de participation :
- participation spontanée
- ou participation au Dépistage Organisé avec invitation, mis en place en 2020.
Rappel du dépistage population générale
Dépistage par tranches d’âge :
- de 25 à 29 ans examen cytologique, deux à un an d’intervalle, puis 3 ans plus tard ;
- à partir de 30 ans et jusqu’à 65 ans, test HPV tous les 5 ans .
Dépistage chez les « filles DES »
Recommandation de l’INCa 2020 : « les femmes à risque majoré de cancer du col de l’utérus, femmes immunodéprimées et femmes exposées in utero au DES peuvent nécessiter une surveillance plus rapprochée ».
La majorité des recommandations internationales sont en faveur d’un dépistage annuel (Hatch 2019, NCI DES and cancer, Australie 2020, Tournaire 2021, SFCPCV 2021).
Néanmoins, les données recueillies en 2023 en France incitent à privilégier le dépistage tous les 3 ans qui correspond au rythme conseillé pour le dépistage cytologique.
En raison des risques accrus de dysplasie du col ou du vagin et du risque éventuel d’ACC tardif chez les « filles DES », le dépistage diffère de celui de la population générale :
- Pour les dates : tous les 3 ans.
- Pour la méthode :
- prélèvements col et vagin : col puis voute vaginale avec le même dispositif.
- association de l’examen cytologique et du test HPV.
- A poursuivre même après hystérectomie.
- Arrêt de la surveillance après 65 ans.
Cette surveillance concerne les « filles DES » dont les résultats des tests précédents sont sans particularité. Dans les autres cas, le suivi peut être plus rapproché.
CONCLUSION PRATIQUE POUR LE DÉPISTAGE DES CANCERS CHEZ LES « FILLES DES »
Consultation annuelle
- Examen des seins
- • Spéculum :
- Inspection du col et du vagin : ACC (lésion polypoïde) ? (voir fig. 2)
- Prélèvement de dépistage : voir plus haut
- Toucher vaginal : nodule pouvant évoquer un ACC ?
Colposcopie en cas de lésion suspecte ou d’anomalie au dépistage.
Interventions sur le col de l’utérus
Schmidt et coll. (1980) ont attiré l’attention sur le risque de sténose après des interventions sur le col telles que la conisation. Ceci amène à privilégier, si possible, les interventions a minima, en particulier l’ablation à l’anse à la conisation chirurgicale classique.
Références
Herbst AL, Ulfelder H, Poskanzer DC. Adenocarcinoma of vagina : association of maternal stilbestrol therapy with tumor appearance in young women. N Engl J Med. 1971;284:878-81. https://doi.org/10.1056/nejm197104222841604
Troisi R, Hatch EE, Titus-Ernstoff I, Hyer M, Palmer J, Robboy S, Strohsnitter W, Kaufman R, Herbst A, Hoover R. Cancer risk in women prenatally exposed to diethylstilbestrol. Internat J of Cancer. 2007;121:356-60. https://doi.org/10.1002/ijc.22631
Hoover RN, Hyer M, Pfeiffer RM, Adam E, Bond B, Cheville AL, et coll. Adverse health outcomes in women exposed in utero to diethylstilbestrol. N Engl J Med. 2011;365:1304-14. https://doi.org/10.1056/nejmoa1013961
Keller C, Nanda R, Shannon RL, Amit A, Kaplan AL. Concurrent primaries of vaginal clear cell adenocarcinoma and endometrial adenocarcinoma in a 39-year old woman with in utero diethylstilbestrol exposure.IntJGynecolCancer. 2001;11:247-50. doi: 10.1046/j.1525-1438.2001.01007.x. https://ijgc.bmj.com/content/11/3/247
Verloop J, van Leeuwen FE, Helmerhorst TJM, van Boven HH, Rookus MA. Cancer risk in DES daughters. Cancer Causes Control. 2010;21:999-1007 https://doi.org/10.1007/s10552-010-9526-5
Smith EK, White MC, Weir HK, Peipins LA, Thompson TD. Higher incidence of clear cell adenocarcinoma of the cervix and vagina among women born between 1947 and 1971 in the United States. Cancer Causes Control. 2012;23:207-11. https://doi.org/10.1007/s10552-011-9855-z
Herbst AL, Anderson D. Diethylstilbestrol (DES) Pregnancy Treatment: A Promising Widely Used Therapy with Unintended Adverse Consequences. AMA J Ethics. 2015;17:865-70. https://doi.org/10.1001/journalofethics.2015.17.9.mhst1-1509
Lee EK, Lindeman NI, Matulonis UA, Konstantinopoulos PA. POLE-mutated clear cell cervical cancer associated with in-utero diethylstilbestrol exposure. Gynecol Oncol Rep. 2019;28:15-17. https://doi.org/10.1016/j.gore.2019.01.012
Hanselaar A, van Loosbroek M, Schuurbiers O, Helmerhorst T, Bulten J, Bernhelm J. Clear cell adenocarcinoma of the vagina and cervix. An update of the central Netherlands registry showing twin age incidence peaks. Cancer. 1997;79:2229-36. https://doi.org/10.1002/(sici)1097-0142(19970601)79:11%3C2229::aid-cncr22%3E3.0.co;2-x
Hatch EE, Herbst AL, Hoover RN, Noller KL, Adam E, Kaufman RH, Palmer JR, Titus-Ernstoff L, Hyer M, Hartge P, Robboy SJ. Incidence of squamous neoplasia of the cervix and vagina in women exposed prenatally to diethylstilbestrol (United States). Cancer Causes Control. 2001;12:837-45. https://doi.org/10.1023/a:1012229112696
Troisi R, Hatch EE, Palmer JR, Titus L, Robboy SJ, Strohsnitter WC, Herbst AL, Adam E, Hyer M, Hoover RN. Prenatal diethylstilbestrol exposure and high-grade squamous cell neoplasia of the lower genital tract. Am J Obstet Gynecol. 2016;215:322.e1-8. https://doi.org/10.1016/j.ajog.2016.03.007
Agence Nationale de Sécurité du Médicament et Produits de Santé (ANSM) : www.has-sante.fr En particulier fichier pdf : Complications liées à l’exposition in utero au DES – Mise au point 2011.
Haute Autorité de Santé (HAS) : www.has-sante.fr Recommandations dépistage du cancer du col de l’utérus : Recommandations en santé publique : Évaluation de la recherche des papillomavirus humains (HPV) en dépistage primaire des lésions précancéreuses et cancéreuses du col de l’utérus et de la place du double immuno-marquage p16/Ki67. Date de validation par le collège : 10 juillet 2019
Institut National du Cancer (INCa) : www.e-cancer.fr Femmes exposées in utero au DES
Etats-Unis : National Cancer Institute : www.cancer.gov Pages consacrées au DES
Australie www.cancer.org.au Page consacrée au DES
Tournaire M, Lafaye N, Levadou A. Screening for cancers of the cervix and vagina in women exposed to diethylstilbestrol. J Gynecol Obstet Hum Reprod. 2021;50:102042. https://doi.org/10.1016/j.jogoh.2020.102042
Société Française de Colposcopie et de Pathologie Cervico-Vaginales (SFCPCV) : www.societe-colposcopie.com
Tournaire M, Gondry J, Mauny L, Devouche E, Morcice P. Late cervical and vaginal clear cell adenocarcinoma in women exposed in utero to diethylstilbestrol. J Gynecol Obstet Hum Reprod. 2023;52:102630. doi: 10.1016/j.jogoh.2023.102630.
CANCER DU SEIN
Risque
Niveaux de risque, définis par la Haute Autorité de Santé (HAS) en 2014 :
http://www.has-sante.fr/portail/jcms/c_1710848/fr/cancer-du-sein
On attribue aux femmes sans facteur de risque particulier de cancer du sein le niveau de référence 1.
C’est par comparaison avec cette population de référence que s’établit le Risque Relatif (RR) avec 3 niveaux :
Facteurs de risque en France
Caractéristiques des facteurs de risque du cancer du sein, par ordre décroissant de Risque Relatif (Sources : HAS 2014 et 2019)
| Niveau de risque | RR |
| Elevé | >4 |
| Modéré | > 2 et ≤ 4 |
| Modeste | >1,1et ≤2 |
| Risque élevé > 4 |
| • Femme porteuse d’une mutation génétique BRCA 1 ou 2 |
| • Antécédent personnel de cancer invasif du sein, de carcinome canalaire ou lobulaire in situ, ou d’hyperplasie atypique |
| • Densité mammaire élevée après la ménopause |
| • Antécédent de deux cancers du sein ou plus chez des parentes au premier degré |
| • Irradiation thoracique médicale à haute dose (Maladie de Hodgkin) |
| Risque modéré >2 et ≤4 |
| • Lésions proliférantes mammaire sans atypies |
| • Un cas de cancer du sein chez une parente de premier degré (mère, sœur, fille) |
| Risque Modeste >1,1 et ≤2 |
| • Exposition au DES in utero |
| • Traitement hormonal substitutif de la ménopause |
| • Ménopause tardive, ≥ 55 ans |
| • Age des premières règles < 12 ans |
| • Alcool |
| • Sédentarité |
| • Diabète |
| • Haut niveau de revenus |
| • Personnel navigant |
| • Obésité après la ménopause |
| • Contraception hormonale orale |
Risque de cancer du sein après exposition au DES in utero, dans quatre études.
| Auteurs | Pays | Dates | RR DES/Témoins | IC 95% | RR DES/ Pop. générale | IC 95% |
| Palmer | USA | 2006 | 1,91 | 1,09-3,33 (S) | – | – |
| Verloop | Pays-Bas | 2010 | – | – | 1,11 | 0,92-1,34 (NS) |
| Tournaire | France | 2015 | 2,1 | 1,60-2,76 (S) | 2,33 | 1,93-2,72 (S) |
| Troisi | USA | 2017 | 1,05 | 0,79-1,41 (NS) | 1,17 | 1,01-1,36 (S) |
RR = risque relatif ; IC 95% = intervalle de confiance ; S = significatif ; NS = non significatif.
Ce risque apparaît multiplié par 2 environ dans l’étude américaine de Palmer et l’étude française, par comparaison avec des femmes non exposées (Palmer 2006, Tournaire 2015).
L’étude néerlandaise n’a pas trouvé d’augmentation significative de risque. Notons que la méthode de cette étude a été critiquée, du fait de l’absence de groupe témoin et parce que l’exposition au DES n’a pu être confirmée que dans une minorité de cas (Verloop 2010).
Fin 2017, le fait nouveau remarquable est la réduction de l’incidence de cancers du sein dans la même cohorte en 11 ans : risque relatif exposées au DES /non exposées 1,91(S) en 2006 (Palmer) et 1,05 (NS) en 2017 (Troisi).
Cette évolution rappelle celle des Adénocarcinomes du col utérin ou du vagin (ACC), avec un pic de fréquence puis une baisse, ce qui serait une caractéristique de l’effet des perturbateurs endocriniens dont le DES est considéré comme un modèle.
En résumé, deux études avaient observé une multiplication par deux du risque de cancer du sein chez les « filles DES » ce qui les situaient à la limite entre les niveaux de risques « modéré » et « modeste » de la HAS. Une nouvelle étude, qui demande à être confirmée, fait espérer qu’avec l’avancée de l’âge ce risque se situe au même niveau que celui des femmes non exposées.
Dépistage
Recommandations de dépistage en France :
Programme de dépistage organisé
Il a été institué en 2004. Son taux de participation était de 50,3% en 2016-2017.
Il faut ajouter 10 à 15% de femmes se faisant dépister dans le cadre d’une détection individuelle.
Modalités de dépistage organisé : mammographie et examen clinique des seins tous les deux ans de 50 à 74 ans.
Recommandations de la HAS en 2019
Un classement des facteurs de risque a été effectué au moyen d’une revue systématique de la littérature qui retenait deux groupes :
Le groupe 1 : « programme national organisé » qui comprend :
• les femmes sans facteur de risque personnel ou familial particulier. C’est le « risque moyen ».
• les facteurs de risque pour lesquels l’évaluation a montré que le dépistage organisé restait adapté : cette liste comporte l’exposition prénatale au DES.
Le groupe 2 correspondant à « des risques justifiant potentiellement un dépistage spécifique pour lesquels il est nécessaire de poursuivre l’évaluation ».
La HAS continue donc d’évaluer la stratégie de dépistage, en particulier l’éventualité de poursuivre le dépistage au-delà de 74 ans.
CONCLUSION PRATIQUE POUR LE DÉPISTAGE DU CANCER DU SEIN CHEZ LES “FILLES DES“
Examen clinique annuel des seins à partir de 25 ans, comme pour toutes les femmes. Mammographies selon le risque global :
• Exposition au DES seule : dépistage « standard », mammographie tous les deux ans de 50 à 74 ans
• Association à d’autres facteurs de risque (voir tableau plus haut) : dépistage spécifique ?
Références
Haute Autorité de Santé (HAS) : www.has-sante.fr
Recommandations dépistage du cancer du sein 2004, 2011, 2014, 2015, 2019 http://www.has-sante.fr/portail/jcms/c_2024559/fr/depistage-et-prevention-du-cancer-du-sein http://www.has-sante.fr/portail/upload/docs/application/pdf/2015-04/refces_k_du_sein_vf.pdf https://www.has-sante.fr/upload/docs/application/pdf/2014-05/depistage_du_cancer_du_sein_chez_les_femmes_a_haut_ risque_volet_1_vf.pdf
Modalités spécifiques de dépistage pour les femmes à haut risque (article mis à jour en 2019)
Palmer JR, Wise LA, Hatch EE, Troisi R, Titus-Ernstoff L, Strohsnitter W, Kaufman R, Herbst AL, Noller KL, HYER M, Hoover RN. Prenatal diethylstilbestrol exposure and risk of breast cancer. Cancer Epidemiol Biomarkers. 2006;15:1509-14. https://doi.org/10.1158/1055-9965.epi-06-0109
Tournaire M, Devouche E, Espié M, Asselain B, Levadou A, Cabau A, Dunbavand A, Grosclaude P, Epelboin S. Cancer risk in women exposed to diethylstilbestrol in utero. Therapie. 2015;70:433-441. https://doi.org/10.2515/therapie/2015030
Verloop J, van Leeuwen FE, Helmerhorst TJM, van Boven HH, Rookus MA. Cancer risk in DES daughters. Cancer Causes Control. 2010;21:999-1007 https://doi.org/10.1007/s10552-010-9526-5
Troisi R, Hatch E, Titus L, Strohsnitter X, Gail MH, Huo D, Adam E, Robboy SJ, Hyer M, Hoover RN, Palmer JR. Prenatal Diethylstilbestrol Exposure and Cancer Risk in Women. Environ Mol Mutogen. 2017. https://doi.org/10.1002/em.22155
ENDOMÉTRIOSE
L’endométriose se définit comme la présence de tissu de l’endomètre, (muqueuse qui tapisse l’intérieur de l’utérus), en dehors de la cavité utérine. En fonction de sa localisation on distingue deux catégories d’endométriose qui se manifestent de façons différentes :
- l’endométriose externe qui se situe sur le péritoine (tissu qui tapisse la cavité de l’abdomen), les trompes, les ovaires, le rectum, la vessie, etc.
- l’endométriose interne ou adénomyose située dans l’épaisseur du myomètre (muscle de l’utérus).
Endométriose externe
Causes
Les mécanismes expliquant la survenue de l’endométriose ne sont pas complètement connus. L’hypothèse prioritaire est celle d’un reflux du sang des règles par les trompes, et de l’implantation de cellules de l’endomètre dans la cavité abdominale. Le niveau d’exposition aux hormones estrogènes comme le DES jouerait un rôle.
Fréquence
L’endométriose est une affection gynécologique assez fréquente puisqu’elle concerne environ 10 % des femmes de la population générale. Il est établi que 30 à 40 % d’entre elles connaîtront des problèmes de fertilité.
En cas d’exposition au DES in utero la fréquence globale de l’endométriose est multipliée par deux environ soit 20 %. Elle peut même atteindre 50 % en cas d’infertilité.
Cette augmentation pourrait être liée à plusieurs conséquences de l’exposition au DES :
- les malformations de l’utérus et des trompes,
- la plus grande fréquence d’interventions sur l’utérus. C’est spécialement le cas de la conisation qui
se complique souvent, chez les « filles DES », de rétrécissement voir d’obstruction du canal du col
de l’utérus, lesquels favorisent le reflux des règles dans l’abdomen; - l’augmentation de l’exposition aux estrogènes lors de la vie intra utérine.
Pour les filles de troisième génération, nées des « filles DES » il n’a pas été observé à ce jour d’augmentation des cas d’endométriose.
Symptômes et conséquences
Les lésions se présentent comme de petites taches noires. Dans les ovaires, elles prennent la forme de kystes, c’est-à-dire de poches contenant du sang brun foncé. Ceux-ci peuvent être volumineux, jusqu’à 10 cm de diamètre. Les conséquences de l’endométriose sont le plus souvent des douleurs et/ou une infertilité, mais parfois des troubles digestifs ou urinaires.
Le symptôme majeur est la douleur, parfois très intense, notamment lors des règles, ce qui est caractéristique de la maladie, mais parfois de façon continue.
Cette maladie peut être silencieuse, sans aucun symptôme, et être découverte à l’occasion d’un bilan pour infertilité. Les explications données pour ce lien entre endométriose et stérilité sont multiples :
- lésions au niveau des trompes,
- effet toxique sur les ovocytes et les spermatozoïdes, en raison de l’inflammation qui accompagne l’endométriose,
- perturbation de l’ovulation en cas d’atteinte des ovaires.
En cas d’exposition au DES il s’ajoute à l’endométriose plusieurs facteurs d’infertilité tels que malformation des trompes, anomalies de l’implantation de l’embryon dans l’utérus, malformation ou conisation du col.
Diagnostic
Le premier symptôme qui fait évoquer l’endométriose est la douleur des règles ou dysménorrhée. Une des difficultés de rattacher ce symptôme à l’endométriose est que la dysménorrhée est présente, à différents niveaux, chez 70 à 90 % des femmes jeunes.
Les signes qui peuvent évoquer l’endométriose sont l’intensité de la douleur, sa résistance au traitement ou son apparition secondaire après des années de règles indolores.
L’échographie permet de repérer les kystes de l’ovaire caractéristiques de l’endométriose. L’IRM est habituellement plus précise que l’échographie pour certaines localisations. En pratique le seul examen qui apporte une certitude est la cœlioscopie.
Traitement
Les médicaments antalgiques ont bien sûr leur place.
Si leur effet est insuffisant un traitement hormonal est efficace dans la majorité des cas.
Le traitement chirurgical permet de retirer ou de détruire les lésions d’endométriose. Cette intervention peut se faire lors de la cœlioscopie diagnostique. Dans les formes étendues l’ouverture de l’abdomen peut être nécessaire.
Endométriose interne ou adénomyose
L’adénomyose se caractérise par la présence d’ilots de tissu d’endomètre dans l’épaisseur du muscle de l’utérus. Elle peut se rencontrer chez des femmes jeunes mais se découvre le plus souvent dans la période 40 – 50 ans. Elle se manifeste le plus souvent par des règles abondantes, prolongées et parfois douloureuses.
Le diagnostic se fait grâce à l’échographie, parfois à l’hystéroscopie (qui visualise la cavité de l’utérus), à l’hystérographie (radio de l’utérus), ou dans certains cas par l’IRM.
Le traitement est le plus souvent médical, avec des médicaments destinés à réduire l’abondance, la fréquence et les douleurs des règles. Il peut être chirurgical. Dans certains cas sévères l’ablation de l’utérus peut être nécessaire.
Références
Missmer SA, Hankinson SE, Spiegelman D, Barbieri RL, Michels KB, Hunter DJ. In utero exposures and the incidence of endometriosis. Fertil Steril. 2004;82:1501-8. https://doi.org/10.1016/j.fertnstert.2004.04.065
Upson K, Sathyanarayana S, Scholes D, Holt VL. Early-life factors and endometriosis risk. Fertil Steril. 2015;104:964-971.https://doi.org/10.1016/j.fertnstert.2015.06.040
Stillman RJ, Miller LC. Diethylstilbestrol exposure in utero and endometriosis in infertile females. Fertil Steril. 1984;41:369- 72. https://doi.org/10.1016/s0015-0282(16)47713-7
Ottolina J, Schimberni M, Makieva S, Bartiromo L, Fazia T, Bernardinelli L, Viganò P, Candiani M, Gentilini D. Early-life factors, in-utero exposures and endometriosis risk: a meta-analysis. Reprod Biomed Online. 2020;41:279-289. https://doi.org/10.1016/j.rbmo.2020.04.005
FIBROMES
Les fibromes sont des tumeurs bénignes de l’utérus. Deux études ont observé une augmentation modéré de l’ordre de 12% de la fréquence des fibromes chez les “filles DES” comparées à des femmes non exposées (Mahalingaiah 2014).
Références
Mahalingaiah S, Hart JE, Wise LA, Terry KL, Boynton-Jarrett R, Missmer SA. Prenatal diethylstilbestrol exposure and risk of uterine leiomyomata in the Nurses’ Health Study II. Am J Epidemiol. 2014;2:186-91. https://doi.org/10.1093/aje/kwt250
FERTILITÉ
Avec l’avancée de l’âge des « filles DES », cette question se pose rarement.
Le taux des «filles DES» qui consultaient pour des problèmes d’infertilité était de l’ordre de 30 % au lieu de 10% environ dans la population générale.
Problèmes spécifiques de fertilité
- Insuffisance de glaire cervicale : les anomalies du col, ainsi que certains traitements (électrocoagulation, cryothérapie, laser, conisation), diminuent la sécrétion de la glaire cervicale, ce qui peut générer une difficulté au passage des spermatozoïdes.
- Endométriose : plus fréquente chez les « filles DES».
- Perturbations de la fonction ovarienne.
- Malformations utérines : leur retentissement sur la fertilité est variable. On peut observer un défaut d’implantation de l’embryon, en raison de la minceur de la muqueuse utérine ou d’un défaut de vascularisation de cette muqueuse.
Ce sont ces mêmes causes qui sont incriminées pour expliquer la plus grande fréquence de fausses couches du premier trimestre.
Traitements
Les méthodes sont les mêmes, qu’il y ait une exposition au DES ou non. L’insémination intra-utérine peut être employée chez les femmes qui présentent une insuffisance de glaire cervicale. La fécondation in-vitro est une méthode de deuxième intention en cas d’échec des inséminations, ou est pratiquée d’emblée s’il existe une anomalie des trompes.
Ces techniques sont menées avec le souhait d’éviter les grossesses multiples en raison du risque accru d’accouchement prématuré chez les « filles DES ».
GROSSESSE
Les complications de grossesses ont représenté des conséquences fréquentes et sévères du DES. Ces grossesses sont maintenant très rares.
Particularités
EVOLUTION DES GROSSESSES CHEZ LES « FILLES DES », COMPARÉE À CELLE D’UN GROUPE TÉMOIN. (Tournaire 2004 et Hoover 2011)
| Evolution | Risque relatif |
| Grossesses extra-utérines | 4 à 13 |
| Fausses couches 1er trimestre | 1,6 à 2,5 |
| Fausses couches tardives | 4à14 |
| Accouchements prématurés | 2 à5 |
| Pré-éclampsie | 1,4 |
| Hémorragie de la délivrance | 1,9 |
| Accouchements à terme | Non exposées : 84% / « Filles DES » : 51% |
L’évolution des grossesses chez les « filles DES » se caractérise par des taux d’accidents plus élevés : grossesses extra-utérines, fausses couches précoces, fausses couches tardives et prématurité. Pour ces raisons, ces grossesses doivent être considérées comme à haut risque.
Grossesse extra-utérine
Le moins bon fonctionnement des trompes après exposition au DES explique que la grossesse s’arrête dans une trompe : dans 5% des grossesses environ, soit 6 fois plus souvent qu’en l’absence d’exposition au DES.
Fausses couches précoces
Le nombre de ces fausses couches est plus élevé après exposition au DES, de l’ordre de 25% en moyenne, contre 15% en l’absence d’exposition au DES. La première cause de ce type de fausses couches est une anomalie chromosomique accidentelle lors de la fécondation. S’y ajoute, après exposition au DES, des difficultés d’implantation de la grossesse, liées à des anomalies de la structure et de la vascularisation de l’utérus.
Fausses couches tardives
Ces fausses couches, au cours du 4ème ou 5ème mois (de 15 à 24 semaines d’absence de règles) se caractérisent par l’ouverture du col de l’utérus, suivie de l’expulsion du fœtus. Il s’agit d’un accident particulier à l’exposition au DES in utero, puisqu’il se produit en moyenne dans 8% des grossesses de « filles DES », c’est-à-dire qu’il est 10 fois plus fréquent que dans la population non exposée au DES.
Ces accidents sont expliqués par les dimensions réduites de la cavité de l’utérus et par la faible résistance du col de l’utérus.
Prématurité
Globalement le taux d’accouchements prématurés est augmenté, multiplié par 2 à 5 selon les études.
Accouchement à terme
En l’absence d’exposition au DES, le taux moyen d’accouchements à terme (entre 37 et 41 semaines) est de 85%, tandis qu’après exposition au DES, ce taux est de 50% environ.
Jumeaux
Ces grossesses sont particulièrement redoutées puisqu’elles ajoutent au risque de prématurité des grossesses gémellaires, celui qui est attaché au DES.
Prise en charge
Repos
Il est destiné à réduire les risques de fausse couche tardive et de prématurité et peut aller de la simple réduction des activités professionnelles ou sportives à un repos strict au lit, voire en hospitalisation.
Le décret du 30 juin 2006 permet une meilleure prise en charge de l’arrêt de travail, selon les modalités « congé de maternité », Cerfa n° 51178#02.
Cerclage
Son but est de renforcer la résistance du col pour éviter son ouverture trop précoce.
Il se fait habituellement par la voie vaginale sous une brève anesthésie générale et consiste à placer un fil ou un ruban autour du col, comme le lien d’une bourse.
Le cerclage peut être utilisé dans deux situations, soit, le plus souvent, à titre préventif à la fin du premier trimestre, soit en cas de raccourcissement ou d’ouverture du col au cours du deuxième trimestre.
Hystéroplastie d’agrandissement.
La cavité de l’utérus peut être déformée par des épaississements du muscle utérin. Sous hystéroscopie, on sectionne les épaississements musculaires qui déforment la cavité utérine. Il ne s’agit pas d’une intervention de première intention chez les patientes n’ayant eu aucun antécédent d’infertilité et/ou d’accident gravidique. Cette intervention s’envisage chez celles qui ont eu une stérilité prolongée inexpliquée, des échecs répétés des implantations lors des fécondations in vitro, ou des avortements spontanés à répétition.
Une étude de 2018 (Ducellier) portant sur 112 femmes apporte des résultats favorables dans le cas d’utérus en T, pour le taux de grossesses obtenues après infertilité. Après fausses couches à répétition il a été observé une réduction du taux de fausses couches de 78% à 22% et une augmentation de naissances d’enfants vivants passant 2,5% à 60%.
Références
Tournaire M, Epelboin S, Lafay-Pillet MC, Bulwa S, de Medeiros N, Raynal P. Surveillance des grossesses chez les femmes exposées au DES in utero. In Carbonne B. Mises à jour en gynécologie et obstétrique CNGOF Paris 2004:79-107. http://www.cngof.fr/component/rsfiles/apercu?path=Journes%2Bnationales%252FMAJ%2Ben%2BGO%252F2004%252FGynecologie %2Bobstetrique%2B-%2BTome%2BXXVIII%252F2004_Go_079_tournaire.pdf&i=698
Hoover RN, Hyer M, Pfeiffer RM, Adam E, Bond B, Cheville AL, et coll. Adverse health outcomes in women exposed in utero to diethylstilbestrol. N Engl J Med. 2011;365:1304-14. https://doi.org/10.1056/nejmoa1013961
Ducellier-Azzola G, Lecointre L, Hummel M, Pontvianne M, Garbin O. Hysteroscopic enlargement metroplasty for T-shaped uterus : 24 years’ experience at the Strasbourg Medico-Surgical and Obstetrical Centre (CMCO). Eur J Obstet Gynecol Reprod Biol. 2018;226:30-34. https://doi.org/10.1016/j.ejogrb.2018.04.036
RISQUES CARDIO-VASCULAIRES ?
Pour la première fois en 2018, une étude prospective a montré une augmentation des risques de maladie coronarienne (ou angine de poitrine) et d’infarctus du myocarde chez les « filles DES », comparées à un groupe témoin (Troisi 2018).
Les risques relatifs (RR) étaient de :
• 1,74 pour la maladie coronarienne.
• et 2,20 pour l’infarctus.
Il n’y avait pas d’augmentation de risque d’accident vasculaire cérébral.
Cet article a été rapporté par la revue Prescrire (n°440, juin 2020) avec la conclusion suivante (Prescrire 2020) : « En pratique, les résultats de cette étude certes fragiles, sont un signal fort. La prudence est de considérer que l’exposition in utero au DES est un facteur de risque cardiovasculaire à l’âge adulte, à prendre en compte par les personnes concernées et par les professionnels de santé qu’elles consultent. »
Conclusion pratique
Notons que cette élévation chez les « filles DES » est considérée comme modeste par rapport aux autres facteurs de risques majeurs que sont l’hypertension artérielle, le tabac, l’excès de poids, l’alcool, la sédentarité.
Par ailleurs, cette information d’augmentation de risque doit être placée dans son contexte :
• le taux d’accidents cardio-vasculaires est moins élevé chez les femmes avant la ménopause que chez les hommes, mais il augmente fortement après celle-ci, au point de se rapprocher du taux d’incidence chez les hommes. C’est ainsi que les accidents cardio-vasculaires sont devenus la première cause de décès chez les femmes, avant les cancers.
• Le diagnostic de ces accidents est plus difficile et souvent plus tardif chez les femmes que chez les hommes du fait de symptômes pouvant être atypiques (INSERM 2020, Fédération Française de Cardiologie 2020).
En pratique, puisque l’exposition au DES fait partie des facteurs non modifiables avec l’hérédité et l’avancée de l’âge, décidons d’agir sur les facteurs modifiables en suivant les conseils de la Fédération Française de Cardiologie : agissons sur le tabac, l’excès de poids, la sédentarité (30 minutes de marche par jour), et prenons la tension artérielle au moins une fois par an.
Références
Troisi R, Titus L, Hatch EE, Palmer JR, Huo D, Strohsnitter WC, Adam E, Richer W, Hyer M, Hoover RN. A prospective cohort study of prenatal diethylstilbestrol exposure and cardiovascular disease risk. J Clin Endocrinol Metab. 2018;103:206-212. https://doi.org/10.1210/jc.2017-01940
Prescrire Rédaction « Exposition in utero au DES : un facteur de risque du myocarde ? » Rev Prescrire 2020;40(440):432-3
Institut National de la Santé Et de la Recherche Médicale (INSERM) : www.inserm.fr – Conférence Le cœur des femmes et des hommes, quelles différences ? (6 février 2020) Voir en particulier à partir de 55’
Fédération Française de Cardiologie : https://www.fedecardio.org/publications/coeur-et-femmes/
CONTRACEPTION
La contraception après 40 ans n’est pas toujours simple. Chez les « filles DES », on doit prendre des précautions supplémentaires en raison des effets à long terme de leur exposition in utero.
Risques liés à l’âge > 40 ans :
- augmentation de risque de cancer du sein,
- augmentation du risque cardio-vasculaire artériel (cardiaque et cérébral), • ainsi que du risque thromboembolique veineux.
Pour ces raisons le Collège National des Gynécologues et Obstétriciens Français (CNGOF) recommande après 40 ans, par ordre de préférence décroissant : les pilules progestatives, le stérilet au cuivre, le stérilet à la progestérone, la contraception locale, la contraception définitive féminine ou masculine. Enfin, en cas de mauvaise tolérance des autres méthodes et en l’absence de contre-indication, la contraception estro- progestative peut être envisagée.
Risques supplémentaires liés à l’exposition au DES (voir plus haut) :
- une possible augmentation du cancer du sein,
- sur le plan cardiovasculaire, une possible augmentation du risque cardio-vasculaire artériel cardiaque.
Chez les « filles DES » les recommandations du CNGOF restent adaptées, en prenant en compte deux particularités :
- les malformations utérines liées au DES, avec souvent hypoplasie et rétrécissements, peuvent rendre la mise en place du stérilet plus difficile. Des stérilets de petite taille peuvent être mieux adaptés,
- la possible augmentation du risque cardio-vasculaire incite à une vigilance particulière pour la contraception.
Références
Collège National des Gynécologues et Obstétriciens Français (CNGOF) : 2018 – Contraception – Recommandations pour la pratique clinique
Pour afficher le fichier à l’écran : http://www.cngof.fr/pratiques-cliniques/recommandations-pour-la-pratique-clinique/ apercu?path=RPC%2BCOLLEGE%252F2018%252FCNGOF_RPC_2018-CONTRACEPTION.pdf&i=21002
Pour télécharger le fichier : http://www.cngof.fr/pratiques-cliniques/recommandations-pour-la-pratique-clinique?folder=RPC%2BCOLLEGE%252F2018
MÉNOPAUSE
La ménopause se définit comme un arrêt des règles depuis au moins 12 mois. Elle est liée à une diminution des œstrogènes. Son âge moyen se situe à 51 ans en France.
Beaucoup de « filles DES » sont concernées en France : elles sont âgées de 46 à 75 ans en 2023 avec un « pic » autour de 53 ans.
Conséquences de la ménopause
Il faut d’abord rappeler qu’une large proportion des ménopauses se passent simplement. Beaucoup cependant subissent des effets indésirables.
Bouffées de chaleur et sueur nocturne.
Elles touchent 80 % des femmes environ mais sont invalidantes chez 25% d’entre elles.
D’autres désagréments tels que insomnies, épisodes dépressifs ou douleurs articulaires sont fréquents.
Sècheresse vaginale
Elle s’aggrave avec la durée de la ménopause avec des conséquences sur la vie sexuelle. Elle s’accompagne souvent de troubles urinaires irritation, infections, incontinence à l’effort.
Ostéoporose
Il s’agit d’une maladie diffuse du squelette avec diminution de la résistance osseuse qui entraîne un risque accru de fracture. Elle est présente chez 10 % des femmes en début de ménopause pour atteindre 50 % à 80 ans. Elle peut être évaluée par une ostéodensitométrie.
Risques cardio-vasculaires
La ménopause facilite la formation d’athérosclérose, susceptible d’entrainer un rétrécissement des vaisseaux, en particulier des artères coronaires, avec son risque d’infarctus du myocarde.
Les études sur les effets du traitement hormonal de la ménopause ont permis de comprendre qu’il existe des effets positifs ou négatifs selon les périodes de traitement.
Le traitement hormonal, en effet, diminue le risque d’infarctus s’il est pris assez tôt, dans les années qui suivent la ménopause. Ceci s’explique par son rôle préventif de la formation de l’athérosclérose. C’est ce qui est appelé la « fenêtre d’intervention thérapeutique ».
Si le traitement hormonal est débuté au-delà de cette période, lorsque l’athérosclérose est constituée, le traitement peut favoriser la rupture de plaques d’athérosclérose, donc augmenter le risque d’infarctus.
Particularités de la ménopause pour les « Filles DES »
Âge de la ménopause
Le taux de ménopause survenant avant 45 ans et plus élevé chez les filles DES, de l’ordre de 16 %, contre 7 % dans la population générale. (Hoover 2011)
Ostéoporose
Il est démontré que l’exposition aux œstrogènes tout au long de la vie a un effet protecteur vis-à-vis de l’ostéoporose. Ceci semble s’appliquer aussi au DES qui est, il faut le rappeler, un estrogène, reçu lors de la vie intra-utérine.
Ainsi, globalement les « filles DES » ont moins d’ostéoporose que la population générale. (Parker SE 2014 )
Une exception cependant : en cas de ménopause précoce, plus fréquente chez les « filles DES », le risque d’ostéoporose est au contraire augmenté, comme chez toutes les femmes.
Risques cardio-vasculaires
Une étude de 2018 a montré que les filles DES avaient un risque d’accidents cardio-vasculaires augmenté : risque d’angine de poitrine multiplié par 1,7 et risque d’infarctus du myocarde multiplié par 2,2. Il n’y avait pas d’augmentation du risque d’accidents vasculaires cérébraux. (Troisi 2018).
Risque de cancers du sein
Les données sur les cancers du sein chez les « filles DES » ont évolué récemment.
Des études américaines et françaises avaient observé une multiplication par 2 du risque de cancer du sein chez les filles DES de moins de 50 ans.
Une réévaluation a trouvé une élévation de risque modérée, avec une augmentation de l’ordre de 10% pour les filles DES de plus de 50 ans, âge de la plupart d’entre elles en France.
(Palmer 2006, Tournaire 2015, Troisi 2017).
Endométriose
L’endométriose est deux fois plus fréquente chez les « filles DES », 20% environ, que dans la population générale. Avec la ménopause, les effets néfastes de l’endométriose, douleurs, saignements, diminuent. C’est un avantage notable de la ménopause. Cependant, en cas de traitement hormonal, celui-ci est susceptible de maintenir ou de réactiver ses effets néfastes.
Prise en charge de la ménopause
Traitements en dehors du traitement hormonal de la ménopause.
Bouffées de chaleur : des préparations à base de phyto-estrogènes peuvent être prescrites, avec une efficacité modeste.
Sècheresse vaginale : les estrogènes par voie vaginale ont une bonne efficacité. Les hydratants et lubrifiants vaginaux peuvent améliorer le confort sexuel.
Ostéoporose : des traitements spécifiques, non hormonaux sont efficaces.
Traitement hormonal de la ménopause (THM).
C’est le traitement le plus efficace pour les effets sévères de la ménopause.
Une des questions qui se pose est donc : THM ou pas ?
Il repose sur l’administration d’œstrogène pour pallier à son déficit après la ménopause, associé à de la progestérone si l’utérus est présent.
On doit en établir la balance avantages / risques pour décider.
Son efficacité a été démontrée pour trois effets de la ménopause :
– C’est le traitement le plus efficace contre les bouffées de chaleur sévères.
– L’effet de réduction de la sécheresse vaginale est habituel mais parfois insuffisant.
– Il est efficace contre l’ostéoporose. Il est pour cette raison spécialement adapté aux ménopauses précoces ou en cas d’ostéoporose diagnostiquée par ostéodensitométrie.
Cependant, il a été l’objet de controverses concernant les risques de cancer du sein et les risques cardio-vasculaires.
En 2002 une vaste étude américaine (WHI) a trouvé une augmentation des cancers du seins, des infarctus et des accidents vasculaires cérébraux (AVC).
Il s’agissait cependant de traitements différents des traitements français et de patientes plus âgées et plus souvent obèses. Ceci a cependant entraîné une réduction des prescriptions de THM, en particulier en France.
Des études récentes françaises, anglaises et finlandaises avec des hormones plus proches des hormones naturelles n’ont pas trouvé d’augmentation des cancers du sein pour des traitements d’une durée de 5 ans. Elles ont aussi trouvé que le risque d’infarctus du myocarde n’est pas augmenté mais diminué pour un THM utilisé moins de 10 ans après la ménopause. (CNGOF et GEMVi 2021)
On peut donc conclure que la balance bénéfices/risques du THM est favorable chez les femmes de 50 à 60 ans (ou de moins de 10 ans après la ménopause) en l’absence de contre indications telles qu’un antécédent de cancer du sein.
Chez les « filles DES », l’évolution favorable du risque de cancer du sein avec l’avancée de l’âge a modifié l’attitude vis-à-vis du traitement de la ménopause : ces nouvelles données de risque proche de celui de la population générale permettent de proposer ce traitement plus couramment, en préférant des traitements courts, de quelques années.
En 2021 Le Collège National des Gynéco-Obstétriciens Français (CNGOF) et le groupe d’étude de la ménopause (GEMVi) ont élaboré des recommandations que nous allons détailler et adapter aux « filles DES ».
Les choix se font lors d’une consultation d’évaluation personnalisée mettant en balance bénéfices/risques du traitement hormonal.
- Age de la ménopause,
- effets négatifs de la ménopause ? bouffées de chaleur sévères, risque d’ostéoporose (en cas de doute ostéodensitométrie),
- risques cardio-vasculaires
- risque global de cancer du sein.
Il importe d’entendre les souhaits des femmes vis-à-vis du traitement. Nous avons observé qu’il existe souvent, chez les « filles DES » une réticence vis-à-vis des traitements hormonaux, ce qui est bien compréhensible.
SI un THM est prescrit, il est maintenant conseillé de débuter pendant les 10 premières années suivant la ménopause c’est-à-dire dans la « fenêtre d’intervention thérapeutique » et avant 60 ans.
Il est aussi conseillé de réduire les facteurs de risques évitables pour les risques cardio-vasculaire et de cancer : sédentarité, surpoids, alcool et tabac.
La surveillance a lieu lors d’une consultation annuelle au cours de laquelle, en cas de traitement hormonal, la balance bénéfice/risque sera réévaluée.
Et bien sûr il fut inclure la surveillance recommandée pour les “filles DES” (voir paragraphes « Cancers du col de l’utérus et du vagin » et « Cancer du sein) :
- Dépistage annuel (ou à des intervalles inférieurs à 3 ans) du cancer du col de l’utérus à poursuivre au-delà de 65 ans
- Le rythme de mammographie actuellement recommandé est le rythme « standard », tous les deux ans, sauf si le risque global est augmenté par d’autres facteurs de risques.
CONCLUSION
Les « filles DES » ont certaines particularités : risque d’infarctus du myocarde augmenté, risque de cancer du sein modérément augmenté d’après les informations récentes, mais risque d’ostéoporose diminué (sauf en cas de ménopause précoce plus fréquente chez elles).
La prise en charge dépend d’une analyse personnalisée qui doit tenir compte de l’intensité des effets négatifs de la ménopause tels que bouffées de chaleur et ostéoporose, des effets favorables ou défavorables du traitement hormonal de la ménopause et bien sûr des souhaits de la femme.
Le traitement hormonal de la ménopause peut être prescrit, y compris chez les « filles DES » après évaluation de la balance bénéfices/ risques. Il doit être débuté dans les 10 ans qui suivent la ménopause avec réévaluation chaque année.
Références
Hoover RN, Hyer M, Pfeiffer RM, Adam E, Bond B, Cheville AL, et coll. Adverse health outcomes in women exposed in utero to diethylstilbestrol. N Engl J Med. 2011;365:1304-14. https://doi.org/10.1056/nejmoa1013961
Parker SE, Troisi R, Wise LA, Palmer JR, Titus-Ernstoff L, Strohsnitter WC, Hatch EE. Menarche, menopause, years of menstruation, and the incidence of osteoporosis: the influence of prenatal exposure to diethylstilbestrol. J Clin Endocrinol Metab. 2014;99:594-601.
Palmer JR, Wise LA, Hatch EE, Troisi R, Titus-Ernstoff L, Strohsnitter W, Kaufman R, Herbst AL, Noller KL, HYER M, Hoover RN. Prenatal diethylstilbestrol exposure and risk of breast cancer. Cancer Epidemiol Biomarkers. 2006;15:1509-14. https://doi.org/10.1158/1055-9965.epi-06-0109
Tournaire M, Devouche E, Espié M, Asselain B, Levadou A, Cabau A, Dunbavand A, Grosclaude P, Epelboin S. Cancer risk in women exposed to diethylstilbestrol in utero. Therapie. 2015;70:433-441. https://doi.org/10.2515/therapie/2015030
Troisi R, Hatch E, Titus L, Strohsnitter X, Gail MH, Huo D, Adam E, Robboy SJ, Hyer M, Hoover RN, Palmer JR. Prenatal Diethylstilbestrol Exposure and Cancer Risk in Women. Environ Mol Mutogen. 2017. https://doi.org/10.1002/em.22155
Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML et coll.; Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. JAMA. 2002 Jul 17;288(3):321-33. doi: 10.1001/jama.288.3.321. https://doi.org/10.1001/jama.288.3.321
Trémollieres F, Chabbert-Buffet N, Plu-Bureau G, Rousset-Jablonski C, Lecerf JM, Duclos M, et coll. Les femmes ménopausées : recommandations pour la pratique clinique du CNGOF et du GEMVi (Texte court) [Postmenopausal women management: CNGOF and GEMVi clinical practice guidelines (Short version)]. Gynecol Obstet Fertil Senol. 2021;49:305-317. French. doi: 10.1016/j.gofs.2021.03.010. https://doi.org/10.1016/j.gofs.2021.03.010
EFFETS COMMUNS AUX “FILLES DES” ET AUX “FILS DES”
EFFETS PSYCHIQUES
Le risque de complications psychiatriques chez les personnes exposées in utero au DES fait l’objet d’études aux résultats discordants et de débats.
En 2011, la Revue Prescrire a fait une synthèse :
« Troubles psychiques après exposition in utero au DES » (Revue Prescrire, 2011).
En résumé, trois études à grands effectifs ont été retenues.
- Une étude américaine de 1991 comparant 1711 femmes exposées in utero à 919 non exposées, a montré que les femmes exposées in utero au DES avaient reçu plus souvent un diagnostic d’anorexie mentale et/ou de boulimie, ou de perte de poids inexpliquée (Gustavson 1991).
- Une étude française de 2007, qui a comparé 1680 hommes et femmes exposés in utero et 1447 membres
de leur fratrie non exposés, n’a pas trouvé de différences entre les deux groupes quant à la fréquence des hospitalisations en psychiatrie, des suicides, et des consultations auprès de psychiatres ou de psychologues (Verdoux 2007). - Une étude américaine de 2010 comparant 1612 femmes exposées in utero et 74628 femmes non exposées a conclu que les épisodes de dépression étaient 1, 5 fois plus fréquents chez les « filles DES » (O’Reilly 2010).
L’association française HHORAGES
Cette association cherche à « établir la relation de cause à effet entre la prise d’hormones sexuelles de synthèse lors des grossesses et tous les troubles générés, à plus ou moins long terme, chez les enfants issus de ces grossesses », en mettant « l’accent en particulier sur les troubles psychiques : dépressions récurrentes, anorexie, boulimie, maniaco-dépressions, schizophrénies associés ou non à des dysfonctionnements et/ou malformations. »
En 2012, une étude comparant les fratries de 529 familles, a recensé plusieurs centaines de cas de troubles psychiques chez les filles ou les garçons exposés in utero à des œstrogènes de synthèse (DES seul ou DES associé à de l’éthinylestradiol). Toutefois, les 529 familles interrogées sont membres de l’association HHORAGES, ce qui crée des biais importants (Soyer-Gobillard 2012). Selon le commentaire des auteurs eux-mêmes, cette étude ne correspond pas aux normes épidémiologiques. Ces travaux ont fait l’objet d’une nouvelle publication en 2016 (Soyer-Gobillard, 2016).
En 2017, nouvelle étude française
Cette étude a comparé 2566 femmes exposées in utero à 2967 femmes non exposées. La conclusion est une augmentation significative (RR 1,7) de la consultation d’un psychologue ou un psychiatre, pour la population exposée (Verdoux, 2017).
Conclusion
Dans l’ensemble, ces données conduisent à considérer comme vraisemblable l’augmentation du risque de troubles psychiques tels que dépression et troubles du comportement alimentaire chez les personnes exposées in utero au DES.
Notons que se pose alors la question du mécanisme d’un tel effet : direct par action du DES sur le système nerveux ou indirect par effets secondaires des accidents de la vie tels que cancer, infertilité, accidents de grossesses liés au DES.
Références
Prescrire – Anonyme – Troubles psychiques après exposition in utero au DES : La Revue Prescrire, 2011;31:513-16 https://www.prescrire.org/Fr/SummaryDetail.aspx?IssueId=440
Gustavson CR, Gustavson JC, Noller KL, O’Brien PC, Melton LJ, Pumariega AJ, Kaufman RH, Colton T. Increased risk of profound weight loss among women exposed to diethylstilbestrol in utero. Behav Neural Biol. 1991;55:307-12. https://doi.org/10.1016/0163-1047(91)90645-7
Verdoux H, Roperts J, Costigliola D, Clavel-Chapelon F, Paoletti X. Serious psychiatric outcome of subjects prenatally exposed to diethylstilboestrol in E3N cohort study. Psychol Med. 2007;37:1315-22. https://doi.org/10.1017/s0033291707000438
O’Reilly EJ, Mirzaei F, Forman MR, Ascherio A. Diethylstilbestrol exposure in utero and depression in women. Am J Epidemiol. 2010;171:876-82. https://doi.org/10.1093/aje/kwq023
Soyer-Gobillard MO, Sultan C. Behavioral and Somatic Disorders in Children exposed in utero to Synthetic Hormones : a Testimony-Case Study in a French Family Troop. In: State of The Art of Therapeutic Endocrinology 2012, Intech Sameh Magdeldin Editeur. 67-86.https://www.intechopen.com/books/state-of-the-art-of-therapeutic-endocrinology/behavioral-and-somatic-disorders-in- children-exposed-in-utero-to-synthetic-hormones-a-testimony-case
Soyer-Gobillard MO, Paris F, Gaspari L, Courtet P, Sultan C. Association between fetal DES-exposure and psychiatric disorders in adolescence/adulthood: evidence from a French cohort of 1002 prenatally exposed children. Gynecol Endocrinol. 2016;32:25-9. https://doi.org/10.3109/09513590.2015.1063604
Verdoux H, Devouche E, Tournaire M, Levadou A. Impact of prenatal exposure to diethylstilbestrol (DES) on psychological outcome: a national survey of DES daughters and unexposed controls. Arch Womens Ment Health. 2017;20:389-395 https://doi.org/10.1007/s00737-016-0711-8
ORIENTATION SEXUELLE
Une des questions posées depuis de nombreuses années pour les « filles et fils DES » est la suivante : est-ce que l’exposition au DES est susceptible de modifier leur orientation sexuelle ?
- L’identité sexuelle est définie par des caractéristiques biologiques comprenant les chromosomes, les hormones et les organes génitaux.
- L’orientation sexuelle est caractérisée par l’attraction ou les pratiques sexuelles, hétérosexuelles, homosexuelles ou bisexuelles.
Une étude de 2020 (Troisi) a évalué la relation entre exposition au DES in utero et orientation sexuelle chez 3306 femmes et 1848 hommes en comparant avec des femmes et hommes « témoins » non exposés. Les conclusions sont les suivantes :
- les « filles DES » rapportaient moins fréquemment une orientation homosexuelle avec un taux diminué de moitié environ (risque relatif 0,44, statistiquement significatif),
- les « fils DES » rapportaient une augmentation du taux d’homosexualité de 44% (risque relatif 1,44), mais selon les auteurs, ce taux n‘était pas statistiquement significatif en raison du faible nombre de cas.
Nous pouvons retenir des effets opposés de l’exposition au DES in utero, en ce qui concerne l’orientation homosexuelle : diminution chez les femmes et augmentation possible chez les hommes.
Référence
Troisi R, Palmer JR, Hatch EE, Strohsnitter WC, Huo D, Hyer M, Fredriksen-Goldsen KI, Hoover R, Titus L. Gender Identity and Sexual Orientation Identity in Women and Men Prenatally Exposed to Diethylstilbestrol. Arch Sex Behav. 2020;49:447-454. https://doi.org/10.1007/s10508-020-01637-7
MALADIES DU PANCRÉAS, DIABÈTE
Une étude de Troisi (2020) a évalué les risques de pancréatites, cancer du pancréas, lithiase biliaire (calculs biliaires) et diabètes chez les « enfants DES ».
Il a été observé, chez les « filles DES » une augmentation des risques de pancréatites (inflammation du pancréas) et de cancer du pancréas. Cependant, cette augmentation concernait les traitements par hautes doses de DES et non les doses basses habituellement prescrites en France (Tournaire 2012).
Il n’y avait pas d’augmentation de risque de pancréatites ni de cancer du pancréas chez les « fils DES ».
Parmi les causes des pancréatites et cancers du pancréas se trouvent les lithiases biliaires et le diabète qui ont été aussi évalués. Il n’y avait pas d’augmentation des taux de lithiase ni de diabètes chez les « filles DES » ou les « fils DES », information utile et bienvenue par ailleurs.
Il s’agit de signaux d’alerte faibles, comme l’écrivent les auteurs eux-mêmes, en raison de la méthode, par questionnaires avec difficultés de vérification des diagnostics, et du faible nombre de cas.
En pratique ces informations n’ont pas d’implication pratique de prévention ou de dépistage.
Références
Troisi R, Hyer M, Titus L, Palmer JR, Hatch EE, Huo D, Aagaard KM, Strohsnitter WC, Hoover RN. Prenatal diethylstilbestrol exposure and risk of diabetes, gallbladder disease, and pancreatic disorders and malignancies. J Dev Orig Health Dis. 2021;12:619-626. https://doi.org/10.1017/s2040174420000872
Tournaire M, Devouche E, Epelboin S, Cabau A. Diethylstilbestrol exposure : evaluation of the doses received in France. Eur J Epidemiol. 2012;27:315-6. https://doi.org/10.1007/s10654-012-9677-7
Références – sites internet d’autres pays.
Etats-Unis
•American Cancer Society: www.cancer.org
Pages consacrées au DES : https://www.cancer.org/cancer/cancer-causes/medical-treatments/des-exposure.html et https://www.cancer.org/content/dam/CRC/PDF/Public/8864.00.pdf
• Centers for Disease Control and Prevention : www.cdc.gov
Le site consacré au DES n’a pas été mis à jour depuis 2012 et a été archivé. Il est accessible par ce lien :https://web.archive.org/web/20210302194044/https:/www.cdc.gov/des/
• National Cancer Institute : www.cancer.gov
Pages consacrées au DES : http://www.cancer.gov/about-cancer/causes-prevention/risk/hormones/des-fact-sheet
Suivi de la cohorte DES : https://www.desfollowupstudy.org/index.asp
Canada
• Société canadienne du cancer : www.cancer.ca
En particulier : https://cancer.ca/fr/cancer-information/cancer-types/cervical/risks#ci_diethylstilbestrol_des_12_801_09 https://cancer.ca/fr/cancer-information/cancer-types/vaginal/risks#ci_diethystilbestrol_des_54_3136_03
Australie
• Cancer Council Australia : www.cancer.org.au
https://www.cancercouncil.com.au/cervical-cancer/about-cervical-cancer/#risk-factors https://www.cancercouncil.com.au/vaginal-cancer/#What-causes-vaginal-cancer
Page consacrée au DES : https://wiki.cancer.org.au/australia/Clinical_question:DES-exposed_women
• Royal Australian and New Zealand College of Obstetricians and Gynaecologists :
Pays-Bas
• NVOG (Nederlandse Vereniging voor Obstetrie en Gynaecologie) – DES Centrum
Protocole de dépistage préventif des « filles DES » élaboré en 2011 en coopération avec le DES Centrum, discuté lors de la réunion du Groupe de Travail Col de l’Utérus du NVOG le 12 décembre 2011. https://www.descentrum.nl/pathtoimg.php?id=421&image=screening_versie_gyneacologen.pdf
Guide pratique destiné aux professionnels de la santé
Depuis 2015, l’association édite un Guide Pratique, mis à jour régulièrement. Deux versions existent :
- un résumé en 4 pages
- la version complète de 38 pages.
Ce Guide Pratique est également destiné à favoriser l’échange d’informations entre professionnels de santé et « familles DES ».
Vous pouvez consulter et télécharger ce guide à l’aide des liens ci-dessous (disponibles en bas de chaque page du site) ou en vous rendant sur la page Nos publications.
